Muatan listrik, properti dasar zat dibawa oleh partikel dasar. Muatan listrik, bisa bernilai positif atau negatif, terjadi dalam satuan alami yang terpisah dan tidak diciptakan atau dihancurkan.
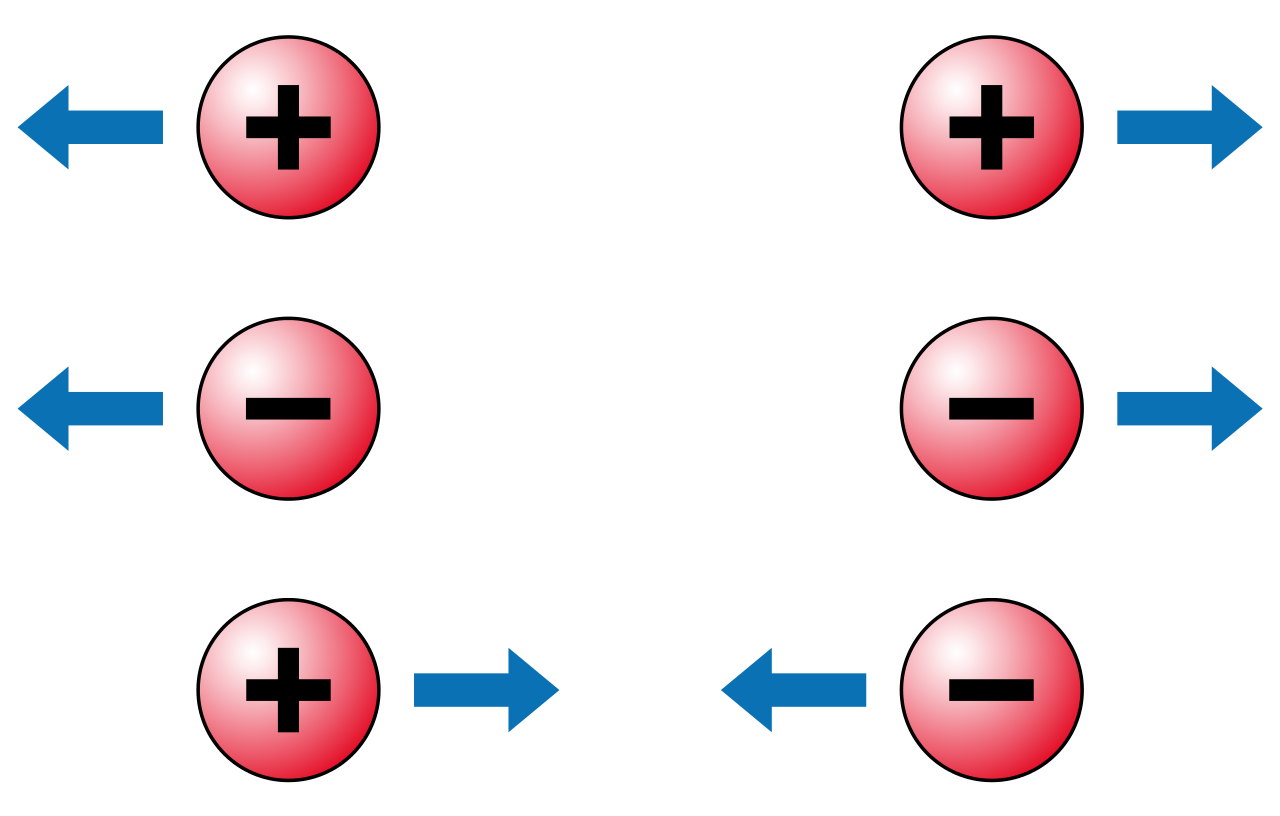
Jenis umum muatan listrik yaitu positif dan negative. Dua objek yang memiliki kelebihan satu muatan akan memberi gaya tolak-menolak saat objek itu berdekatan.
Dua objek yang memiliki kelebihan muatan berlawan, satu positif dan yang lain negative, akan memberi gaya tarik-menarik ketika objek itu berdekatan. (Lihat Coulomb force.)
Elektron negatif dan proton positif. Jadi, bagian dari objek biasanya bermuatan netral, karena tersusun dari atom bermuatan netral.
Elektron juga terikat di atom tapi tidak semua elektron. Beberapa elektron yang paling jauh dari nukleus bisa dilepas dengan beberapa cara. Jika elektron yang bisa dilepas ini dilepas, akan ada kekurangan elektron di tubuh aton. Setelah, pelepasan beberapa elektron dari atom netral jumlah proton di atom lebih banyak dari elektron. Alhasil, tubuh atom bermuatan positif.
Tidak hanya tubuh atom melepas elektron, dia juga bisa menyerap elektron bebas dari luar. Dalam hal ini, tubuh atom bermuatan negatif.
Jadi, kekurangan atau kelebihan elektron pada tubuh atom disebut muatan elektron. Muatan elektron sangat kecil yaitu
Objek bermuatan adalah contoh dari listrik statis. Dikarenakan, muatan listrik terperangkan di objek itu sendiri. Dimana, tidak ada pergerakan (statis).
Tapi ketika muatan listrik bergerak, ini menyebabkan arus Listrik. Muatan listrik telah melakukan kerja/usaha. Artinya memiliki potential untuk menarik muatan lawan atau menolak muatan sejenis. Muatan adalah hasil dari terpisahnya elektron dan proton.
Banyak dasar, atau subatom, partikel dari zat memiliki property dari muatan listrik. Contohnya, electrons bermuatan negative dan protons bermuatan positif, tapi neutrons tidak bermuatan. Muatan negative dari setiap elektron ditemukan dengan eksperimen untuk memiliki besar yang sama, dimana juga sesuai dengan muatan positif masing-masing proton. Muatan maka ada dalam satuan alami sesuai dengan muatan sebuah elektron atau proton, sebuah konstanta fisika dasar. Pengukuran langsung dan tepat dari electron’s charge, sebagai satuan alami muatan listrik, pertama kali dibuat (1909) pada Millikan oil-drop experiment. Atoms dari zat bermuatan netral karena nukleusnya mengandung jumlah proton yang sama dengan jumlah elektron yang mengelilingi nucleus. Arus Listrik dan objek bermuatan menyangkut perpisahan beberapa muatan negative dari atom netral.
Arus pada kawat besi terdiri dari aliran elektron yang ikatannya lebih longgar dari tiap atom. Beberapa atom di permukaan batang kaca bermuatan positif dengan cara menggosokkannya ke kain sutra, sehingga kehilangan elektron, menjadi bermuatan positif karena proton yang tidak netral pada nucleus. Objek bermuatan negative memiliki kelebihan elektron pada permukaannya.
Muatan listrik tidak berubah: pada system terisolasi, di bahan kimia apapun, atau reaksi nuklir, muatan listrik bersihnya selalu konstan. Jumlah aljabar dari muatan mendasar tetap sama. (Lihat konservasi muatan.)
Satuan muatan listrik dalam meter–kilogram–sekon dan sistem SI adalah coulomb, ekuavalen dengan jumlah bersih muatan listrik yang mengalir lewat cross section dari sebuah konduktor di dalam sirkuit listrik selama tiap detik ketika arus memiliki nilai satu amper. Satu coulomb terdiri dari 6.24 × 1018 unit muatan listrik alami, seperti elektron atau proton tersendiri. Satu elektron memiliki muatan negative sebesar 1.6021766208 × 10−19 coulomb. Dalam centimetre–gram–second system ada dua satuan muatan listrik: satuan muatan elektrostatik , esu, atau statcoulomb; dan satuan muatan elektromagnetik, emu, atau abcoulomb. Satu coulomb muatan listrik adalah sekitar 3,000,000,000 esu, atau sepersepuluh emu.
Sebuah satuan muatan elektrokimia, yaitu faraday, berguna dalam menggambarkan reaksi electrolysis, seperti electroplating logam. Satu faraday sama nilainya dengan 9.648533289 × 104 coulombs, dan muatan dari satu mole electrons (yaitu, Avogadro’s number, 6.022140857 × 1023, electrons).
:max_bytes(150000):strip_icc()/electrical-sparks--artwork-548000401-5989ea456f53ba001118af4b.jpg)
Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.