Sebuah atom didefinisikan sebagai partikel penyusun terkecil dari sebuah substansi yang dapat ada dengan sendirinya atau yang digabung dengan atom lain membentuk molekul.
Atom adalah unit terkecil dari materi dan memberi bentuk elemen. Kata "atom" berasal dari kata Greek artinya tidak terbagi, karena pada waktu itu atom dianggap sebagai hal terkecil di alam semesta dan tidak dapat dibagi lagi. Sekarang kita tahu bahwa atom terdiri dari tiga partikel penyusunnya : proton, neutron, dan elektron-dimana terdiri dari penyusun yang lebih kecil lagi, seperti quarks.
Atom diciptakan setelah proses Big Bang 13.7 miliar tahun yang lalu. Dimana alas semesta yang panas dan padat menjadi dingin, kondisi ini memungkinkan Quarks dan elektron untuk muncul. Quark bergabung membentuk proton dan neutron yang menjadi nukleus. Ini beberapa menit awal terbentuknya alam semesta, bersumber dari CERN.
Butuh waktu 380.000 tahun sehingga alam semesta cukup dingin, sehingga elektron melambat dan dapat ditangkap mereka untuk membentuk atom. Awal mula atom hanya berupa hydrogen dan helium, dimana masih menjadi senyawa paling banyak di alam semesta, menurut Jefferson Lab. Gravitasi akhirnya membuat gas-gas berkoalisi membentuk bintang, dan membentuk atom paling berat (dan masih) yang berada dalam bintang dan terkirim ke alam semesta ketika bintang meledak (supernova).
Pada tahu 1808, kimiawan, fisikawan, dan meteorologis terkenal dari Inggris John Dalton mempublikasikan teorinya tentang atom. Pada waktu itu, banyak fenomena kimia yang tidak dapat dijelaskan bisa dipecahkan lewat Teori Dalton. Oleh karena itu, teori itu menjadi dasar teori kimia. Postulat dari Teori Atom Dalton adalah berikut.
- Semua hal tersusum dari partikel terkecil yang tidak dapat dibagi dan tidak dapat dihancurkan disebut atom.
- Semua atom dari element yang sama memiliki properti yang mirip tapi berbeda dengan atom pada elemen lainnya.
- Atom dari element lain bergabung membentuk senyawa.
- Reaksi kimia bukan apa-apa selain penyusunan kembali atom-atom.
- Atom tidak dapat diciptakan atau dihancurkan dengan cara apapun.
Teori Dalton memiliki beberapa kekurangan seperti; sekarang kita tahu bahwa atom dapat dihancurkan. Juga, beberapa atom dari elemen yang sama berbeda dari segi massa (isotop). Teori ini juga gagal menjelaskan adanya alotrop.
Tapi di era modern konsep atom didasarkan pada jasa model atom Rutherford and model atom Bohr. Semua substansi tersusun dari atom. Semua atom tersusun dari,
1. Nukleus
2. Elektron
Partikel Atom
Quantum Microscope Image dari sebuah Atom
Untuk mengertinya lebih baik, mari kita buat sedikit ilustrasi (tapi atom tidak serapih ini ) :
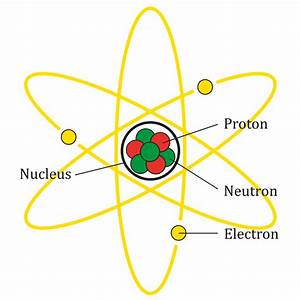
Proton dan neutron lebih berat dari electron dan tinggal di nukleus di pusat atom. Electron sangatlah ringan dan berada di langit-langit mengitari nukleus. Langit-langit elektron memiliki radius 10.000 kali lebih besar dari nukleusnya sendiri. Menurut Los Alamos National Laboratory.
Proton dan neutron punya masa yang hampir sama. Tetapi, satu proton 1.835 kali lebih berat dari elektron. Atom selalu memiliki jumlah proton dan elektron yang sama, dan jumlah proton dengan neutron umumnya sama juga. Menambah proton ke atom membentuk elemen baru, dan menambah neutron membentuk isotop, yang merupakan versi lebih berat dari atom itu.
Nukleus Atom
Nukleus ditemukan pada tahun 1911 oleh Ernest Rutherford, seorang fisikawan New Zealand. Di tahun 1920, Rutherford mengajukan nama proton untuk partikel bermuatan positif dari atom. Dia juga berteori bahwa partikel netral ada di dalam nukleus, dimana James Chadwick, Fisikawan Inggris dan murid dari Rutherford, berhasil membuktikannya di tahun 1932.
Proton dan neutron penyusun nukleus diperkirakan bermasa (proton sedikit lebih ringan) sama dan memiliki momentum sudut atau spin yang sama.
Nukleus diunjang dengan gaya kuat, salah satu gaya dasar di alam. Gaya ini melebihi gaya tolak-menolak proton dan neutron, menurut hukum kelistrikan. Beberapa nukleus tidak stabil karena energi ikatan berbeda-beda untuk atom-atom berdasar besar nukleus. Atom ini akan memudar menjadi elemen lain, seperti carbon-14 memudar menjadi nitrogen-14.
Proton
Proton adalah partikel bermuatan positif ditemukan di nucleus atom. Rutherford menemukannya pada eksperimen dengan sinar katode pada tahun 1911 dan 1919. Proton bermasa sekitar 99.86% sama dengan masa neutron.
Jumlah proton pada atom berbeda-beda untuk masing-masing elemen. Contohnya, karbon memiliki 6 proton, hidrogen memiliki 1 dan oksigen memiliki 8. Jumlah proton di atom direferensikan sebagai nomor atom elemen tersebut. Jumlah proton juga mempengaruhi sifat kimia elemen itu. Elemen-elemen disusun dalam Sistem Tabel Periodik dengan urutan nomor atom meningkat.
Tiga quark membuat satu proton – 2 quark ke atas (dengan muatan positif 2/3 masing-masing) dan 1 quark ke bawah (dengan muatan negative 1/3) – dan mereka ditahan bersama-sama oleh subatomic disebut gluon, yang tidak bermasa.
Proton adalah pertikel bermuatan positif. Muatan pada suatu proton adalah 1.6 × 10-19 Coulomb. Jumlah proton pada nukleus dari sebuah atom mewakili jumlah nomor atom dari suatu atom.
Neutron
Keberadaan neutron diteorikan oleh Rutherford pada tahun 1920 dan ditemukan oleh Chadwick pada tahun 1932, menurut American Physical Society. Neutron ditemukan pada eksperimen ketika atom ditembak berkas tipis berilium. Partikel subatom dengan tidak bermuatan terlepas – neutron.
Neutron adalah partikel tidak bermuatan yang ditemukan diseluruh nukleus atom (kecuali hydrogen). Sebuah neutron bermasa lebih berat sedikit dari pada proton. Seperti proton, neutron juga tersusun dari quark - 1 quark ke atas (dengan muatan positif 2/3) dan 2 quark ke bawah (dengan muatan negative 1/3).
Elektron
Elektron lebih kecil dibanding proton dan neutron, lebih dari 1.800 kali lebih kecil dari pada proton maupun neutron. Masa electron hanya sekitar 0.054% dari masa neutron, menurut Jefferson Lab.
Joseph John (J.J.) Thomson, seorang fisikawan Inggris pada tahun 1897, menurut Science History Institute. Yang mulanya dikenal sebagai "corpuscles," electron memiliki muatan negatif dan tertarik dengan muatan positif proton. Elektron mengelilingi inti atom lewat jalur disebut orbital, ide ini diberikan oleh Erwin Schrödinger, seorang fisikawan Austria pada tahun 1920an. Sekarang, model ini dikenal dengan nama model quantum. Orbital bagian dalam mengelilingi atom berbetuk bola, tapi untuk orbital luar bentuknya lebih rumit.
Sebuah electron konfigurasi menunjukkan lokasi electron pada atom tertentu. Menggunakkan konfigurasi electron dan prinsip fisika, kimiawan bias memprediksi property dari atom, seperti kestabilan, titik didih, konduktifitas, menurut Los Alamos National Laboratory.
Sebuah elektron bermuatan negatif ada pada atom. Muatan pada setiap elektron adalah – 1.6 × 10 – 19 Coulomb. Elektron ini mengitari nukleus. Beberapa fakta tentang elektron dalam sebuah atom, ada di bawah,
- Jika sebuah atom memiliki jumlah proton dan elektron yang sama, atom bermuatan netral karena muatan negatif elektron menetralisir muatan positif proton.
- Elektron mengorbit sekitar kulit nukleus
- Gaya tarik-menarik dipancarkan oleh nukleus yang bermuatan positif kepada elektron yang bermuatan negatif. Gaya tarik-menarik ini bekerja seperti gaya sentripetal yang menyebabkan elektron mengorbit sekeliling nukleus.
- Elektron yang berada dekat nukleus terikat erat dengan nukleus dan lebih susah untuk terlepas dari nukleus dibanding elektron yang berada lebih jauh dari nukleus.
- Struktur atom Alumunium terlihat pada gambar berikut-
- Sejumlah energi tertentu dibutuhkan untuk melepas elektron dari orbitnya. Energi yang dibutuhkan untuk melepas elektron pada orbit pertama lebih besar dari energi untuk melepas elektron pada orbit lebih luar. definite amount of energy is required to remove the electron from its orbit. Hal ini dikarenakan gaya tarik-menarik oleh nukleus terhadap elektron di orbit dalam lebih besar dari pada terhadap elektron di orbit lebih luar. Sama halnya, energi yang diperlukan kulit kedua lebih dikit dari kulit pertama, dan lebih besar dari kulit ketiga. Oleh karena itu, dapat kita katakan elektron pada orbit berhubungan dengan suatu energi tertentu. Maka orbit atau kulit direferensikan sebagai tingkatan energi.
- Tingkatan energi dilambangkan dengan huruf K, L, M, N, dst. Dimana, K paling dekat nukleus dan memiliki tingkatan energi paling rendah, dan kebalikannya orbit terluar memiliki tingkat energi yang paling tinggi.
- Jumlah maksimum elektron yang ada pada tingkatan energi manapun dirumuskan dengan, ‘2n2’, dimana, n adalah bilangan bulat dan mewakili "prinsip bilangan kuantum". Untuk tingkat energi yang berbeda nilai 'n' dan jumlah elektron disajikan pada tabel berikut
Sl. No.
|
Tingkat energi pada orbit (kulit)
|
Prinsip bilangan kuantum ‘n’
|
Jumlah maksimum elektron(2n2)
|
1
|
K
|
1
|
2 × 12 = 2
|
2
|
L
|
2
|
2 × 22 = 8
|
3
|
M
|
3
|
2 × 32 = 18
|
4
|
N
|
4
|
2 × 42 = 32
|
- Rumus diatas (2n2) digunakan untuk menentukan jumlah maksimum elektron di kulit manapun, punya beberapa batas. Jumlah elektron kulit terluar (tingkat energi paling tinggi) tidak bisa lebih dari 8. Contohnya atom Kalsium, memiliki 20 elektron mengitari nukleus. Berdasar rumus di atas 2n2, distribusi elektron adalah 2 elektron di kulit K, 8 elektron di kulit L dan ada 10 elektron setelahnya. Tapi elektron paling luar tingkat energinya tidak lebih dari 8. Maka, ada 8 elektron di kulit M dan 2 elektron di kulit berikutnya yaitu N. Konfigurasi elektron dari Kalcium di berikan pada gambar di bawah-
- Elektron pada kulit terluar disebut "elektron valensi". Jumlah maksimum "elektron valensi" adalah 8. Jika jumlah elektron pada kulit terluar adalah 8, maka atom tersebut stabil. Materi yang atomnya secara natural memiliki 8 elektron di kulit terluar, tidak bereaksi dengan materi lain. Gas inert seperti Helium, Neon, Argon, krypton etc. memiliki kulit terluar komplit terisi dan tidak bereaksi dengan materi lain.
- "elektron valensi" dari suatu atom terikat secara longgar terhadap nukleus dan bisa dilepas dengan beberapa cara, contoh : dipanaskan, diberi kejut listrik, dll.
- "elektron valensi" membentuk ikatan untuk menyatukan atom-atom suatu materi. Kebanyakan properti materi ditentukan berdasar jenis ikatan ini di dalam materi-materi.
- Masing-masing kulit (tingkatan energi) dibagi lagi menjadi subkulit. Subkulit ini disebut orbital. Orbital dilambangkan dengan s, p, d, f dst. dengan bilangan quantum yang mengikutinya, l = 0, 1, 2, 3, 4,….(n-1) dst. Jumlah subkulit pada kulit sesuai dengan prinsip bilangan kuantum ‘n’. Kapasitas elektron di kulit manapun ditentukan dengan menjumlahkan kapasital elektron pada sub kulit. Maksimum kapasitas elektron dari sub kulit diatur dengan rumus 2(2l +1 ). Kapasitas sub kulit ditunjukan pada tabel dibawah-
Sl. No.
|
Subkulit
|
Bilangan kuantum (l)
|
Kapasitas elektron pada subkulit
2(2l + 1)
|
1
|
s
|
0
|
2(2 × 0 + 1) = 2
|
2
|
p
|
1
|
2(2 × 1 + 1) = 6
|
3
|
d
|
2
|
2(2 × 2 + 1) = 10
|
4
|
f
|
3
|
2(2 × 3 + 1) = 14
|
- Kulit pertama disebut K memiliki bilangan kuantum 1 dan satu s orbital dan s orbital dilambangkan 1s.
- Kulit kedua disebut L memiliki bilangan kuantum 2, dan satu s orbital dan satu p orbital dan mereka dilambangkan 2s dan 2p berturut-turut.
- Kulit ketiga disebut M memiliki bilangan kuantum 3 dan satu s orbital, p orbital, dan satu d orbital dilambangkan 3s, 3p, dan 3d berturut-turut dst.
- Di sini kita punya penting untuk diingat bahwa s orbital memiliki satu suborbital dan setiap suborbital memuat maksimum dua elektrons. Orbital p memiliki 3 suborbital dan orbital d memiliki 5 suborbital.
- Suborbital dengan energi yang lebih rendah yang pertama terisi dan selanjutnya orbit kebih tinggi. Tidak mungkin mengisi orbital lebih tinggi atau suborbital sebelum mengisi penuh orbital yang lebih rendahnya.
Jika kita mempelajari contoh akan lebih jelas
Struktur Atom Alumunium memiliki 13 Elektron
Struktur Atom Copper memiliki 29 Elektron
Dapat dilihat bahwa orbital 3d lebih tinggi tingkat energinya daripada tingkat energi 4s
Struktur Atom Silver memiliki 47 Elektron
Dapat dilihat bahwa orbital 3d lebih tinggi tingkat energinya daripada tingkat energi 4s, dan tingkat energi 4d lebih tinggi dari 5s
Teori Atom Modern
Teori atom modern hanya sedikit berbeda dari Teori Dalton. Disebut juga teori quantum. Konsep he concept of partikel gelombang dualitas dipakai di sini. Dikatakan bahwa elektron yang berupa partikel terkadang berperilaku seperti gelombang. Jadi sebuah atom memiliki sebuah nukleus yang dikelilingi kemungkinan-kemungkian letak elektron. Ukuran dan bentuk dari area kemungkinan bisa dihitung dengan persamaan gelombang.
Sejarah atom
Teori atom telah berkembang paling tidak sejak 440 sebelum masehi sampai zaman Democritus, seorak ilmuwan dan filosofer dari Yunani. Greek scientist and philosopher. Democritus membuat teori atomnya berdasar dari hasil teori filosofer terdahulu, menurut Andrew G. Van Melsen, penulis "From Atomos to Atom: The History of the Concept Atom" (Duquesne University Press, 1952).
Penjelasan Democritus tentang atom dimulai dengan sebuah batu. Sebuah batu dibelah menjadi dua. Kalau terus dibelah, pada akhirnya ada bagian batu yang terlalu kecil untuk dibelah lagi. Kata “atom” berasal dari bahasa Yunani untuk kata tidak dapat dibagi, dimana Democritus menyimpulkan ada titik dimana suatu hal tidak bias dibagi lagi.
Penjelasannya termasuk ide-ide bahwa atom ada terpisah dari satu sama lainnya, ada tak terhitung jumlah atom, atom-atom bisa bergerak, dan mereka bisa bergabung bersama membentuk hal tapi tidak menyatu membentuk sebuah atom baru, dan bahwa mereka tidak dapat dibagi, menurut Universe Today.
Bagaimana, karena kebanyakan filosofer pada waktu itu – terutama tokoh yang berpengaruh Aristoteles – percaya bahwa semua hal tercipta dari tanah, udara, api dan air, teori Democritus dikesampingkan.
John Dalton seorang kimiawan Inggris mengembangkan ide Democritus pada tahun 1803 ketika dia mengusahakan teori atomnya sendiri, menurut chemistry department at Purdue University.
Teori Dalton memuat beberapa ide Democritus, seperti atom tidak bisa dibagi lagi atau dihancurkan dan atom yang berbeda bergabung membentuk hal-hal di dunia. Tambahan dari Dalton di teorinya yaitu: Bahwa semua atom dari suatu elemen akan mirip, bahwa atom dari element lain akan berbeda berat dan propertinya dari atom elemen lain, bahwa atom tidak bisa diciptakan atau dibentuk dan bahwa hal itu dibentuk oleh atom dalam bilangan bulat sederhana.
Thomson, fisikawan Inggris menemukan elektron pada 1897, membuktikan bahwa atom dapat dibagi, menurut Chemical Heritage Foundation. Dia dapat menentukan adanya elektron dengan mempelajari property dari pelepasan elektrik pada sinar katode. Menurut laporan Thomson pada 1897, berkas sinar dibelokkan di dalam tabung, dimana membuktikan bahwa ada sesuatu bermuatan negative dalam ruang hampa. Pada tahun 1899, Thomson mempulikasikan deskripsinya terhadap atom, umumnya dikenal dengan nama "plum pudding model." Dapat dilihat di Chem Team site. Model atom Thomson memuat sejumlah besar elektron terperangkat pada suatu yang menghasilkan muatan positif memberi atom muatan netral secara menyeluruh. Modelnya mirip dengan plum pudding, makanan penutup di Inggris yang terkenal.
Ilmuwan berikutnya yang memodifikasi dan mengembangkal model atom adalah Rutherford, yang belajar dari Thomson, menurut chemistry department at Purdue University. Pada tahun 1911, Rutherford mempublikasikan versi atomnya, dimana memuat nucleus bermuatan positif dikelilingi elektron. Model ini muncul saat Rutherford dan asistannya menembakkan partikel alfa, pada lembaran emas tipis. Partikel alfa terdiri dari dua proton dan dua neutron, dikemas dengan gaya nuklir kuat yang juga mengemas nucleus, menurut Jefferson Lab.
Ilmuwan menemukan bahwa sebagian kecil dari partikel alfa, terbiaskan dengan sudut yang jauh dari arah sebenarnya ketika mereka sulit untuk terbiaskan. Rutherford bisa memperkirakn ukuran nucleus dari atom emas, yaitu 10.000 kali lebih kecil dari ukuran keseluruhan atom, dan banyak bagian atomnnya adalah kosong. Model atom Rutherford masih menjadi basis yang dipakai sekarang.
Beberapa ilmuwan mendalami model atom, termasuk Niels Bohr (membangun teori Rutherford untuk mengikutsertakan property dari elektron berdasar spectrum hydrogen), Erwin Schrödinger (mengembangkan model atom quantum), Werner Heisenberg (menyatakan kita tidak dapat mengetahui keberadaan dan kecepatan elektron secara bersamaan), dan Murray Gell-Mann dan George Zweig (secara independen mengembangkan teori bahwa proton dan neutron tersusun dari quark).
Sumber tambahan:
This article was updated on Sept. 10, 2019, by Live Science contributor Traci Pedersen.







Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.